Het celmembraan scheidt de inhoud van de cel met zijn omgeving, maar om te kunnen functioneren is het wel nodig dat er een zekere permeabiliteit (een duur woord voor doorlaatbaarheid) van chemische stoffen is. Maar de mate van permeabiliteit is verschillend voor verschillende stoffen: we spreken daarom ook wel van semi-permeabiliteit. Kalium, natrium en chloride zijn drie ionsoorten waarvoor de membraan permeabel is. Dit komt door de aanwezigheid van poriën en specifieke kanalen in de membraan, ionkanalen genoemd, die opereren zonder dat daarvoor energie nodig is. Daarnaast zijn er pompen en ionenwisselaars in de lipide dubbellaag die wel energie verbruiken om samenstellingen binnen en buiten de cel te reguleren. Ze zijn nodig omdat anders op termijn de ionensamenstellingen niet intact zouden blijven.
De membraanpotentiaal is het gevolg van de semi-permeabiliteit van het celmembraan en twee processen ter plaatse van het celmembraan spelen hierbij een rol:
- diffusie van een ion door het membraan ten gevolge van concentratieverschillen binnen en buiten de cel;
- beweging van ionen in een elektrisch veld.
De doorlaatbaarheid van het kaliumion is een hoofdrolspeler omdat dit voor een cel 'in rust' de meest doorlaatbare ionsoort is en het zogenaamde \(\mathrm{K}^{+}\) kanaal levert dan een belangrijke bijdrage aan de totstandkoming van de membraanpotentiaal. Maar we zullen de theorie uitleggen voor een willekeurige ionsoort, ook al mag je hierbij best aan \(\mathrm{K}^{+}\) en het \(\mathrm{K}^{+}\) kanaal denken. In ieder geval beginnen we met de speciale situatie dat er maar één ion \(\mathrm{X}^{+}\), met een homogene vloeistofconcentratie binnen groter dan buiten de cel, en maar één kanaaltype voor dit ion in het spel zijn. Laten we voor dit geval de twee processen onder de loep nemen.
De concentratiegradiënt oefent een diffusiekracht uit op de ionen, die ze van gebieden met hoge naar lage concentratie wil laten lopen. Maar omdat ionen een lading hebben ontstaat er door deze bewegingen van de ionen ook een elektrostatische kracht die qua richting tegengesteld is aan die van de diffusiekracht. Naarmate er meer ionen stromen van gebieden van hoge naar lage concentratie neemt de elektrostatische kracht toe. Op een bepaald moment zijn deze twee krachten in evenwicht. De evenwichtspotentiaal voor het betreffende ion heet dan de Nernstpotentiaal van het ion. De wet van Nernst, ook wel Nernstformule genaamd, legt het verband tussen de evenwichtsconcentraties en de Nernstpotentiaal vast.
De evenwichtspotentiaal van een ion is gegeven door \[E_\mathrm{ion}= \frac{RT}{zF}\cdot \ln\left(\frac{C_{\mathrm{e}}}{C_{\mathrm{i}}}\right) = -\frac{RT}{zF}\cdot \ln\left(\frac{C_{\mathrm{i}}}{C_{\mathrm{e}}}\right)\] Deze potentiaal geeft de rustmembraanpotentiaal weer in een model van de cel met één ionsoort en één ionkanaal, en de waarde hangt af van de absolute temperatuur \(T\), de valentie \(z\) (het aantal ladingseenheden per ion) en de ionconcentraties binnen (\(C_{\mathrm{i}}\)) en buiten (\(C_{\mathrm{e}}\)) de cel ter plaatse van het membraan. \(R\) is de gasconstante en \(F\) de constante van Faraday (gelijk aan de lading van een mol eenwaardige ionen).
Diffusie
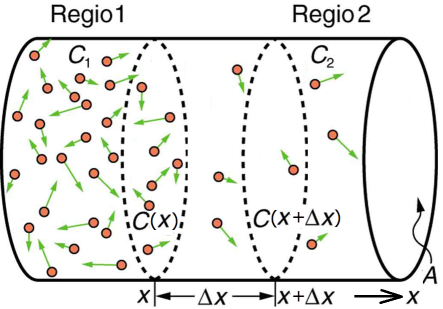
Fysische chemie leert dat er een beweging is van ionen van hoge naar lage concentratie en dat de flux \(\Phi\), d.w.z. de netto verplaatsing van ionen per tijdseenheid per oppervlakte-eenheid in de richting van de afnemende concentratie, gegeven wordt door de wet van Fick: \[\Phi= -D\cdot \frac{\dd C}{\dd x}\] waarbij \(D\) de diffusiecoëfficiënt is en \(\dfrac{\dd C}{\dd x}\) de component van de gradiënt van de concentratie is die wijst in de richting waarin het transport (lokaal) plaatsvindt (in onderstaande tekening de positieve \(x\)-richting). Het minteken verdisconteert dat de richting van het transport er een is van plaatsen met een hoge concentratie naar plaatsen met een lage concentratie. Onderstaande figuur visualiseert dit proces en de formule \[\Phi(x)\cdot \Delta x \approx -D\cdot \bigl(C(x+\Delta x)-C(x)\bigr)\] symboliseert dat het aantal deeltjes dat het volume tussen \(x\) en \(x+\Delta x\) per tijdseenheid instroomt evenredig is met het concentratieverschil op plek \(x\) en \(x+\Delta x\) op dat tijdstip.
Einstein en Nernst hebben de volgende formule voor de diffusieconstante van een geladen deeltje afgeleid: \[D=\frac{RT}{F}\cdot u\] waarbij \(R\) de gasconstante is, \(T\) de absolute temperatuur (in Kelvin), \(F\) de constante van Faraday (de lading van een mol eenwaardige ionen) en \(u\) de 'mobiliteit' van het ion. Wanneer één mol ionen met valentie \(z\) (het aantal ladingseenheden per ion) diffundeert kunnen we dit interpreteren als een elektrische stroom met stroomsterkte \[I_D= zF\cdot \Phi = - zRT\cdot u\cdot \frac{\dd C}{\dd x} \]
Beweging van ionen in een elektrisch veld
Door de diffusiebeweging van ionen in een regio met hoge concentratie naar een regio met lage concentratie, die van elkaar gescheiden zijn door een semipermeabel membraan, ontstaat een ladingsverschil ter plaatse van het membraan. Stel dat het ion positief geladen is, een hoge concentratie binnen de cel heeft, en een lage concentratie buiten de cel heeft, dan zal er door de diffusiebeweging aan de binnenkant in de buurt van het membraan een negatieve lading achterblijven en aan de buitenkant in de buurt van het membraan een positieve lading ontstaan. Het membraan is op deze manier een condensator en naarmate er meer ionen diffunderen zal het ladingsverschil toenemen. Maar dit betekent ook dat er een toenemend potentiaalverschil in de buurt van het membraan ontstaat. Het diffunderen van de ionen zal hierdoor steeds moelijker gaan vanwege tegenwerkende elektrische krachten. De flux \(\Phi_E\) ten gevolge van het elektrisch veld \(E\) dat bij het potentiaalverschil \(V\) past wordt gegeven door de volgende formule: \[\Phi_E=-z\cdot u\cdot C\cdot \frac{\dd V}{\dd x}\] waarbij \(z\) weer de valentie van het ion is en \(\dfrac{\dd V}{\dd x}\) het potentiaalverschil per afstand is. Wanneer één mol deeltjes met valentie \(z\) beweegt in het elektrisch veld kunnen we dit interpreteren als een elektrische stroom met stroomsterkte \[I_E=zF\cdot\Phi_E = -z^2F\cdot u\cdot C\cdot \frac{\dd V}{\dd x}\]
De Nernstvergelijking
Er ontstaat van lieverlee een evenwichtssituatie waarin de diffusiebeweging en de beweging van de ionen in een elektrisch veld even groot, maar tegengesteld gericht zijn; we zeggen wel dat de cel 'in rust' is, maar er is wel beweging van ionen door het membraan waarbij de in- en uitstroom gelijk aan elkaar is. Anders geformuleerd: in evenwicht is de som van de elektrische stroom door diffusie en de beweging in een elektrisch veld, \(I_D+I_E\), gelijk aan nul. Dus: \[I_D+I_E = -z\cdot u\cdot \!\!\left(RT\cdot \frac{\dd C}{\dd x}+zFC\cdot \frac{\dd V}{\dd x}\right)=0\] In evenwicht moet dus de term tussen haakjes gelijk zijn aan nul, en er geldt dan: \[-\frac{RT}{zF}\cdot \frac{1}{C}\cdot \frac{\dd C}{\dd x}= \frac{\dd V}{\dd x}\] Dit impliceert \[-\frac{RT}{zF}\cdot \frac{\dd\ln(C)}{\dd x}= \frac{\dd V}{\dd x}\] en daarom krijgen we bij integratie over de lipide dubbellaag en toepassing van de rekenregel \(\ln(x)-\ln(y)=\ln(x/y)\) de vergelijking \[-\frac{RT}{zF}\ln\left(\frac{C_\mathrm{e}}{C_\mathrm{i}}\right)=V_\mathrm{e}-V_\mathrm{i}\] Dus: \[V_\mathrm{i}-V_\mathrm{e}=\frac{RT}{zF}\ln\left(\frac{C_\mathrm{e}}{C_\mathrm{i}}\right)=\] Het gaat aan de linkerkant om een potentiaalverschil tussen binnen- en buitenkant van het membraan voor een cel in rust, maar in elektrofysiologie is het gebruikelijk om de referentiepotentiaal aan de buitenkant van de cel ter plaatse van het membraan gelijk op nul te stellen. Bij een positief geladen ion met een hogere concentratie aan de binnenkant van de cel in rust zal de potentiaal dan aan de binnenkant van de cel ter plaatse van het membraan een negatieve waarde hebben die we de Nernstpotentiaal of evenwichtspotentiaal van het ion noemen en aanduiden met \(E_\mathrm{ion}\). De gevonden vergelijking heet de wet van Nernst.
In bovenstaand betoog hebben we wel stiekem verondersteld dat de ionstromen zo klein zijn dat de concentraties binnen en buiten de cel er niet door veranderen. Ook hebben we geen rekening gehouden met osmotische druk, oftewel we hebben verondersteld dat deze binnen en buiten de cel even groot zijn. Bij dierlijke cellen zijn deze veronderstellingen in orde.
Laten we eens een afschatting maken voor kaliumionen in een cel met Nernstpotentiaal \(E\) van \(-60\,\mathrm{mV}\). Als specifieke capaciteit \(C\) van het membraan (d.w.z. capaciteit per oppervlakte-eenheid) is een redelijke schatting \(1\,\mathrm{\mu F/cm}^2\). Dit betekent dat de lading \(Q\) op het membraan per oppervlakte-eenheid gegeven wordt door \[Q=C\cdot E= (10^{-6}\,\mathrm{F/cm}^2)\cdot (60\cdot 10^{-3}\,\mathrm{V})=6\cdot 10^{-8}\,\mathrm{C/cm}^2\] Een lading van 1 farad oftewel ongeveer 96500 C, stemt overeen met 1 mol van het monovalente ion. We kunnen zo het aantal ionen dat per vierkante centimeter verplaatst moet worden uitrekenen; dit aantal is in mol ongeveer gelijk aan \[\frac{6\cdot 10^{-8}\,\mathrm{C/cm}^2}{96500\,\mathrm{C/mol}}\approx 6\cdot 10^{-13}\,\mathrm{mol/cm}^2\] Vermenigvuldigen we dit getal met de constante van Avogadro dan betekent dit dat \[(6\cdot 10^{-13}\,\mathrm{mol/cm}^2)\cdot (6\cdot 10^{23}\,\mathrm{mol}^{-1})=3.6\cdot 10^{11}\, \mathrm{cm}^{-2}\] Dit betekent dat 3600 ionen per \(\mu \mathrm{m}^2\) getransporteerd is. Stel dat de cel bolvormig is met een diameter \(d=10\,\mu\mathrm{m}\). Dan hoort hierbij een oppervlakte van \(\pi\cdot d^2\) en dus in het totale aantal getransporteerde ionen gelijk aan \(3600\cdot \pi\cdot 100\approx 1.13\cdot 10^6\). Het volume van de cel is gelijk aan \(\frac{1}{6}\pi\cdot d^3\) en in dit geval ongeveer gelijk aan \(524\,\mu\mathrm{m}^3\). Stel dat de ionconcentratie 100 mM is (en dus gelijk is aan 100 mol/m3), dan komt dit overeen met een aantal ionen gelijk aan \[(100\,\mathrm{mol}/\mathrm{m}^3)\cdot (524\cdot 10^{-18}\,\mathrm{m}^3) \cdot (6\cdot 10^{23} \,\mathrm{mol}^{-1})=3.14\cdot 10^{10}\] Dit betekent dat in een bolvormige cel met een diameter van \(10\mu\mathrm{m}\) ongeveer \(1.13\cdot 10^6\) ionen verplaatst dienen worden op een aantal van \(3.14\cdot 10^{10}\) ionen om een potentiaal van \(-60\,\mathrm{mV}\) te bewerkstelligen. Dat wil zeggen dat de verandering in de ionconcentratie binnen de cel door het ionentransport maar 0,004% is. Dit kunnen we dus best verwaarlozen in berekeningen voor een kort tijdsinterval.
Laten we ook eens concrete getallen invullen: \(F\approx 96485\;\mathrm{C}\,\mathrm{mol}^{-1}\), gasconstante \(R\approx 8.315\,\mathrm{J}\,\mathrm{K}\,\mathrm{mol}^{-1}\), temperatuur \(29.2\,{}^{\circ}\mathrm{C}\) oftewel \(T\approx 302.4\;K\). Dan geldt dat \(E_\mathrm{ion} \approx -\frac{0.0261}{z}\ln\left(\frac{C_\mathrm{i}}{C_\mathrm{e}}\right)\) (in Volt). Het is handiger om niet met de natuurlijke logaritme te werken, maar met de logaritme met grondtal 10 en als eenheid mV te gebruiken voor het potentiaalverschil. Dan krijgen we de volgende formule voor de evenwichtspotentiaal van een ion: \[E_\mathrm{ion}\approx -\frac{60}{z}\cdot \log_{10}\left(\frac{C_\mathrm{i}}{C_\mathrm{e}}\right)\quad\text{(in mV)}\] Let op: dit is de evenwichtspotentiaal bij de gegeven temperatuur van \(29.2\,{}^{\circ}\mathrm{C}\): bij lichaamstemperatuur (\(37\,{}^{\circ}\mathrm{C}\)) is de coëfficiënt in de formule voor de Nernstpotentiaal gelijk aan \(61.5\,\mathrm{mV}\) i.p.v. \(60\,\mathrm{mV}\), en bij een temperatuur van \(20\,{}^{\circ}\mathrm{C}\) is de coëfficiënt in de formule voor de evenwichtspotentiaal gelijk aan \(58.2\,\mathrm{mV}\).
Voor het gemak zullen we in de rest van deze sectie alleen logaritmen met grondtal 10 gebruiken en simpelweg \(\log\) schrijven in plaats van \(\log_{10}\). Ook zullen we, tenzij uitdrukkelijk anders vermeld, een temperatuur van \(29.2\,{}^{\circ}\mathrm{C}\) veronderstellen zodat de evenwichtspotentiaal van een ion berekend kan worden (in mV) met de formule \[\begin{aligned}E_\mathrm{ion}&=-\frac{60}{z}\cdot \log_{10}\left(\frac{C_\mathrm{i}}{C_\mathrm{e}}\right)\\ \\ &= \frac{60}{z}\cdot \log_{10}\left(\frac{C_\mathrm{e}}{C_\mathrm{i}}\right)\quad\text{(in mV)}\end{aligned}\] In dit geval van een eenwaardig ion neemt de evenwichtspotentiaal af met 60 mV bij elke factor 10 concentratieverschil binnen en buiten de cel. In onderstaande tabel is de evenwichtspotentiaal voor een aantal biologisch relevante ionen op basis van eerder in de inleiding gegeven concentraties voor een cel in rust berekend. Controleer deze waarden en let daarbij goed op de valentie van het ion.
\[
\begin{array}{l|rrrr}
\mathrm{ion\;} X & [X]_\mathrm{e} & [X]_\mathrm{i} & [X]_\mathrm{e}\mathrm{\;:\;}[X]_\mathrm{i} & E_\mathrm{ion}\;(\mathrm{mV})\\ \hline
\mathrm{K}^{+} & 5 & 100 & 1\mathrm{\;:\;}20 & -78 \\
\mathrm{Na}^{+} & 150 & 15 & 10\mathrm{\;:\;}\phantom{2}1 & +60\\
\mathrm{Ca}^{2+} & 2 & 0.0002 & 10000\mathrm{\;:\;}\phantom{2}1 & +120 \\
\mathrm{Cl}^{-} & 150 & 13 & 11.5\mathrm{\;:\;}\phantom{2}1 & -64\\
\end{array}\]
 De Nernstpotentiaal voor een ionsoort
De Nernstpotentiaal voor een ionsoort



